Abstrakt
Reproduktiv sağlamlıqda əhəmiyyətli tibbi, sosial və psixoloji problem kimi dəyərləndirilən sonsuzluq hallarının 40–50%-i etioloji baxımdan kişi faktorları ilə assosiasiya olunur. Bu faktorlar arasında ən mühüm genetik səbəblərdən biri Y xromosomunun uzun qolu üzərində yerləşən AZF bölgəsindəki mikrodelesiyalardır. AZFa, AZFb və AZFc alt bölgələrində müşahidə olunan genetik dəyişikliklər spermatogenez prosesinin müxtəlif mərhələlərində dayanma ilə nəticələnərək, klinik praktikada azoospermiya və ya oligozoospermiya ilə təzahür edə bilər. AZFa və AZFb mikrodelesiyaları adətən geri dönməz sonsuzluğa səbəb olduğu halda, AZFc mikrodelesiyaları daha geniş klinik spektrə malikdir və bəzi hallarda süni mayalanma texnologiyaları vasitəsilə fertil potensialın qorunmasına imkan yaradır. Bundan əlavə, AZFc delesiyalarının irsi ötürülmə ehtimalı reproduktiv planlama və genetik məsləhət prosesində xüsusi əhəmiyyət kəsb edir. Bu məqalə Y xromosomunun AZF bölgəsində baş verən mikrodelesiyaların molekulyar-genetik mexanizmlərini, klinik nəticələrini və reproduktiv praktikada diaqnostik rolunu təhlil edir.
Əsas mətn
GİRİŞ
Sonsuzluq (infertillik) – reproduktiv yaşda olan cütlüklərin təxminən 10–15%-ni əhatə edən, tibbi problemlərlə yanaşı, sosial və psixoloji təsirləri də olan çoxşaxəli bir hal kimi qiymətləndirilir [2] [25]. Müasir statistik məlumatlara əsasən, bu hallarının təxminən 40–50%-i kişi faktorları ilə birbaşa əlaqələndirilir. Kişi infertilliyinə səbəb ola biləcək əsas amillər isə hormonal balanssızlıqlar, testikulyar və posttestikulyar mənşəli anatomik pozuntular, infeksiyalar və genetik mənşəli dəyişikliklərdir [15].
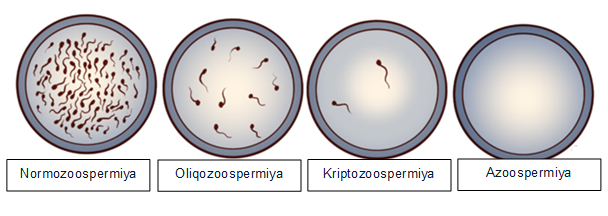
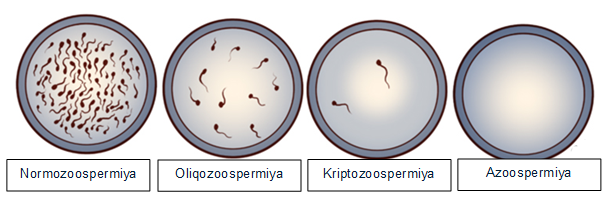
İnfertilliyin təməlində duran səbəblərdən biri genetik dəyişikliklərdir və bu hallar ümumilikdə bütün kişilərin sonsuzluq səbəblərinin təxminən 15–30%-ni təşkil edir [19]. Kişi infertilliyində müşahidə olunan spermatogenetik dəyişikliklərin dərəcələrini və onların genetik anomaliyalarla əlaqəsini vizual şəkildə Şəkil 1-də göstərilmişdir. Burada dörd əsas sperma göstəricisi təqdim olunub: normozoospermiya, oligozoospermiya, kriptozoospermiya və azoospermiya (Şəkil 1; [1] ).
Normozoospermiya — spermanın konsentrasiyası, hərəkətliliyi və morfologiyası normal diapazonda olan vəziyyətdir.
Oliqozoospermiya — spermatozoidlərin konsentrasiyasının normadan (15 milyon/ml-dən) aşağı olması ilə xarakterizə olunur. Bu zaman genetik səbəblərin, o cümlədən Y xromosomu mikrodelesiyaları və ya xromosom polimorfizmlərinin təsiri ehtimalı artır.
Kriptozoospermiya — sperma nümunəsində yalnız çox az sayda spermatozoidin mikroskop altında və ya sentrifuqasiya üsulu ilə aşkarlandığı vəziyyətdir. Bu, spermatogenezin ciddi dərəcədə pozulduğunu göstərir və genetik faktorların rolu daha önə çıxır.
Azoospermiya — ejakulyatda tamamilə spermatozoidlərin olmaması ilə xarakterizə olunur. Bu, həm obstruktiv (keçiriciliyin pozulması), həm də qeyri-obstruktiv (testikulyar funksiyanın çatışmazlığı) səbəblərdən baş verə bilər. Xüsusilə qeyri-obstruktiv azoospermiya hallarında genetik anomaliyaların, məsələn, Klaynfelter sindromu, Y xromosomu AZF delesiyaları və ya digər xromosom pozğunluqlarının tezliyi ən yüksəkdir.
Göstərilən ardıcıllıq onu deməyə əsas verir ki, sperma konsentrasiyası azaldıqca və azoospermiya dərəcəsinə doğru irəlilədikcə, genetik mənşəli səbəblərin klinik əhəmiyyəti yüksəlir. Bu səbəbdən, oligozoospermiya, cryptozoospermiya və xüsusən də azoospermiya diaqnozu qoyulan pasiyentlərdə sitogenetik və molekulyar-genetik testlərin aparılması reproduktiv sağlamlığın dəqiq qiymətləndirilməsi və fərdiləşdirilmiş müalicə strategiyalarının müəyyənləşdirilməsi baxımından həlledici rol oynayır.
Bu kontekstdə xüsusi olaraq vurğulanmalıdır ki, sonsuzluğun genetik əsaslı səbəbləri içərisində ən geniş yayılmış və klinik baxımdan yüksək dəyərə malik olan dəyişikliklərdən biri Y xromosomunun uzun qolu – Yq11 sahəsində yerləşən AZF (Azoospermia Factor) bölgəsində müşahidə edilən mikrodelesiyalardır [19] [27]. Yalnız kişilərdə mövcud olan bu xromosom təkcə cinsin təyin olunmasında deyil, həmçinin spermatogenez prosesinin çoxsaylı mərhələlərinin tənzimlənməsində mühüm funksiyaları olan genləri də özündə birləşdirir.
Beləliklə, AZF bölgəsindəki genetik komplekslərin bütövlüyündə yaranan istənilən struktur dəyişiklik və ya mikrodelesiya, spermatogenezin müəyyən mərhələdə dayanmasına, bunun ardınca isə kişi sonsuzluğunun inkişafına gətirib çıxara bilir [27] [30]. Bu məqalənin əsas diqqət nöqtəsi AZF bölgəsində rast gəlinən mikrodelesiyaların genetik və klinik əhəmiyyətinin təhlilinə yönəlmişdir. Məqsəd bu dəyişikliklərin kişi sonsuzluğu ilə əlaqəsinin elmi əsaslarla qiymətləndirilməsi və klinik praktikada onların diaqnostik əhəmiyyətinin üzə çıxarılmasıdır. Bu yanaşmadan çıxış edərək, aşağıdakı fundamental sualların müzakirəsi aparılmışdır:
●AZF alt bölgələrində baş verən mikrodelesiyalar konkret olaraq hansı patofizioloji və klinik nəticələrə yol açır?
●AZF mikrodelesiyalarının nəsildən-nəslə keçmə riski varmı və bu risklər reproduktiv genetik məsləhətdə necə nəzərə alınır?
●Bütün sonsuzluq hallarının və ya sperm sayının azalmasının AZF bölgəsi ilə genetik əlaqəsi varmı?
Bu sualların cavablandırılması, kişi sonsuzluğunun etiologiyasının aydınlaşdırılması və genetik testlərin düzgün interpretasiyası baxımından mühüm klinik dəyərə malikdir. Beləliklə, AZF bölgəsinin molekulyar strukturu və delesiya nümunələrinin daha dərindən anlaşılması, fərdiləşdirilmiş diaqnostik yanaşmaların formalaşdırılmasına və reproduktiv strategiyaların optimallaşdırılmasına töhfə verə bilməkdədir.
1. AZF Mikrodelesiyalarının Alt Bölgələrə Görə Patofizioloji Nəticələri və Klinik Əhəmiyyəti
Y xromosomunun uzun qolu üzərində (Yq11) lokalizasiya olunan AZF bölgəsi spermatogenez prosesinin mühüm fazalarında rol oynayan gen komplekslərini özündə birləşdirir. Bu bölgə, spermatogenez prosesinin müxtəlif mərhələlərində iştirak edən gen kompleksləri ilə zəngindir. AZF bölgəsində baş verən mikrodelesiyalar, onların yerləşdiyi alt regiondan asılı olaraq fərqli patofizioloji mexanizmləri işə sala və spermatogenezin tam və ya hissəvi dayanması ilə nəticələnə bilər [19] [29]. AZF bölgəsi funksional olaraq üç alt bölgəyə ayrılır: AZFa, AZFb və AZFc. Hər bir alt bölgə unikal gen tərkibinə və patofizioloji təsirlərə malikdir [10] [11] [31]. Şəkil 2-də Y xromosomunun strukturu və AZFa, AZFb, AZFc bölgələrinin lokalizasiyası göstərilmişdir. Klinik praktikada bu bölgələrin mikrodelesiyalarını aşkarlamaq üçün sY84/sY86 (AZFa), sY127/sY134 (AZFb) və sY254/sY255 (AZFc) STS markerləri istifadə olunur. Bu markerlər beynəlxalq konsensus üzrə minimal skrininq panelinə daxildir və onların yoxluğu uyğun bölgədəki mikrodelesiyanı təsdiqləyir (EAA/EMQN təlimatlarına əsasən) [21].
AZFa bölgəsi Yq11.21 üzərində yerləşir və erkən spermatogenez üçün zəruri olan USP9Y və DBY (DDX3Y) genlərini ehtiva edir. Bu bölgədəki mikrodelesiyalara çox nadir rast gəlinsə də, klinik olaraq ən ağır sonsuzluq formalarından biridir [11] [31]. Histoloji baxımdan Sertoli Cell Only Syndrome (SCOS) kimi təzahür edir və bu zaman testisdə yalnız Sertoli hüceyrələri müşahidə olunur (Dicke və əməkdaşları, 2023). Klinik təcrübələrdə AZFa delesiyalarında adətən spermatogoniya hüceyrələri tamamilə yox olduğu üçün, bu formalar demək olar ki, geridönməz azoospermiya ilə nəticələnir və bu səbəbdən, süni mayalanma texnologiyaları — o cümlədən Testikulyar Sperm Ekstraksiyası (TESE) və İntrasitoplazmik Sperm İnyeksiyası (ICSI) — bu pasiyentlərdə adətən effektsiz olur [12].
AZFb alt bölgəsi Yq11.23 sahəsində yerləşir və RBMY1, PRY, CDY2 kimi genləri ehtiva edir ki, bunlar meyoz mərhələsində spermatositlərin yaranması və onların diferensiasiyasında əsas rol oynayır. Müxtəlif tədqiqatlar göstərir ki, AZFb bölgəsində baş verən tam delesiya hallarında spermatogenezin meyoz mərhələsində dayanması — “meiotic arrest” — müşahidə edilir və testikulyar biopsiya analizlərində post‑meyotik germ hüceyrələrinin tamamilə olmaması morfoloji göstərici kimi göstərilir [4] [32]. Klinik baxımdan bu hallarda spermatozoid aşkarlanma ehtimalı son dərəcə aşağıdır və nəticə demək olar ki, həmişə azoospermiya olur (yalnız nadir hallarda kriptozoospermiya müşahidə edilə bilər) [3] [32].
AZFc bölgəsində meydana gələn mikrodelesiyalar, AZF bölgəsində müşahidə olunan genetik dəyişikliklər arasında ən yüksək rastgəlmə tezliyinə malik formadır. Burada yerləşən DAZ (Deleted in Azoospermia) gen kompleksi spermatogenez prosesinin tənzimlənməsində mühüm funksiyalara malikdir. AZFc bölgəsindəki mikrodelesiyalar klinik baxımdan daha az invaziv fenotiplərlə müşayiət oluna bilir; histoloji müayinələrdə SCOS-dan hipospermatogenezə qədər dəyişən morfoloji nəticələr müşahidə edilir [5] [13]. Ən son tədqiqatlar göstərir ki, AZFc mikrodelesiyası olan pasiyentlərin təxminən 40–70%-ində testikulyar toxumada yetkin spermatozoid aşkar edilə bilir, bəzi pasiyentlərin ejakulatında spermatozoid müşahidə oluna bilər və təbii yolla ata olmaq ehtimalı istisna deyil. Bununla belə, əksər hallarda sperm sayı kifayət qədər olmur və belə pasiyentlərdə TESE və ICSI kimi köməkçi reproduktiv texnologiyaların tətbiqinə real perspektiv yaradır ki, bu da onların fertil potensialının qorunub saxlanılmasını mümkün edir. Mövcud ədəbiyyata əsasən, Yamaguchi və həmkarları tərəfindən 2024-cü ildə aparılmış araşdırmada da AZFc mikrodelesiyalarında fertil potensialın qoruna biləcəyi və kliniki hamiləlik göstəricilərinin qənaətbəxş səviyyədə olduğu vurğulanmışdır [20]. Müvafiq olaraq, Xia və həmkarlarının (2025) apardığı geniş miqyaslı araşdırmada b2/b4 alt-tip AZFc delesiyası olan pasiyentlərdə 64.5% sperm tapılma göstəricisi qeydə alınmışdır. Aşağıdakı cədvəl bu bölgələrin genetik və klinik təsirlərini ümumiləşdirir (Cədvəl 1) [14]:
2.1. AZF Mikrodelesiyalarının İrsən Keçmə Potensialı: Klinik və Genetik Perspektivlər
Son on ildə aparılan elmi araşdırmalar, Y xromosomunun AZF bölgəsində müşahidə olunan mikrodelesiyaların yalnız reproduktiv sağlamlıq üçün deyil, eyni zamanda irsiyyət riski baxımından da xüsusi diqqət tələb etdiyini ortaya qoymuşdur.
AZFa və AZFb alt bölgələrində baş verən tam mikrodelesiyalar, adətən spermatogenezin erkən və ya meyoz mərhələsində tamamilə dayanması ilə nəticələnir. Bu halda spermatogoniya və ya spermatositlər mövcud olmur və spermatozoidə rast gəlinmir. Bu səbəbdən, bu bölgələrdəki mikrodelesiyalar irsi ötürülmə ehtimalı olmayan, yəni "de-novo" mutasiyalar kimi qəbul edilir [9] [19] [28]. Əksinə, AZFc alt bölgəsində müşahidə olunan mikrodelesiyalarda spermatogenezin tam dayanması əvəzinə, oligozoospermiya, hipospermatogenez və ya məhdud sayda sperm hüceyrəsinin mövcudluğu müşahidə oluna bilir. Bəzi pasiyentlərdə hətta sperma nümunəsində (ejakulatda) spermatozoid aşkarlanır və bu, onların çox nadir hallarda təbii yolla, əsasən isə süni mayalanma üsulları vasitəsilə ata ola bilməsinə imkan verir [17] [22]. Bu fakt AZFc delesiyalarının irsən ötürülə bilmə ehtimalını gündəmə gətirir. Son illərdə aparılan molekulyar genetik tədqiqatlar göstərir ki, AZFc delesiyası daşıyan kişilərin oğullarında eyni mikrodelesiyanın təkrarlanma ehtimalı 60–100% arasında dəyişə bilər. Bu isə bu tip genetik dəyişikliklərin stabil germ xətti irsiyyətinə malik olduğunu göstərir [17] [24]. Bu səbəbdən, reproduktiv mərhələdə olan pasiyentlər və onların ailə planlaması ilə bağlı qərarları zamanı genetik konsultasiya vacib hesab edilir.
Müxtəlif populyasiyalarda aparılmış araşdırmalar AZFc mikrodelesiyalarının vertikal (atadan oğula) keçə biləcəyini və bu halların klinik konsultasiya və reproduktiv planlama baxımından xüsusi diqqət tələb etdiyini ortaya qoymuşdur. 2022-ci ildə Deng və həmkarları tərəfindən təqdim olunan icmal məqalədə, müxtəlif klinik hesabatlar əsasında AZFc mikrodelesiyalarının vertikal ötürülmə halları sistematik şəkildə təhlil edilmişdir. Müəlliflər təsdiq edirlər ki, AZFc mikrodelesiyası daşıyıcısı olan ataların oğullarında eyni genetik mikrodelesiyanın 60–100% ehtimalla təkrarlanması mümkündür. Bu nəticə, AZFc mikrodelesiyalarının stabil şəkildə germ xəttində qorunub saxlanıldığını və irsiyyətlə ötürülə biləcəyini irəli sürən əhəmiyyətli dəlildir. Bu hallar, reproduktiv genetik konsultasiyada valideyn və uşaqlarda eyni genetik yükün olmasının nəzərə alınmasını zəruri edir [7].
Bənzər şəkildə, Şen və həmkarları tərəfindən 2023-cü ildə Türkiyədə aparılan bir klinik tədqiqatda, non-obstruktiv azoospermiyası olan 129 pasiyentdə genetik analizlər vasitəsilə AZF mikrodelesiyaları qiymətləndirilmişdir. Nəticələr göstərmişdir ki, AZFc mikrodelesiyası daşıyıcısı olan xəstələrin əhəmiyyətli bir hissəsində testikulyar spermatozoid əldə olunması mümkün olmuşdur. Bu isə onların süni mayalanma vasitəsilə ata olmaq imkanını qoruduğunu göstərir [26].
Bu tədqiqatlar birlikdə göstərir ki, AZFc mikrodelesiyası reproduktiv funksiyanın pozulması ilə yanaşı, həm irsiyyət riski, həm də embrionun genetik sağlamlığı üzərində birbaşa təsirə malikdir. Bu səbəbdən, belə hallarda preimplantasiya genetik diaqnostika (PGD) və genetik konsultasiya tibbi qərarvermədə əsaslı rol oynayır. Klinik praktikada bu pasiyentlərin idarəsində, yalnız TESE nəticəsi deyil, həm də potensial genetik ötürülmə riski mütləq şəkildə nəzərə alınmalıdır.
2.2. AZF Bölgəsinin Sonsuzluğa Təsiri: Hər Azoospermiya Genetik Əsaslıdırmı?
Kişi sonsuzluğunda hər bir azoospermiya və ya spermatogenez pozuntusu genetik mənşəli deyildir. Sonsuzluq multifaktorial etiologiyaya malikdir və genetik səbəblər ümumi halların yalnız 15–30%-ni təşkil edir [2]. Bu genetik səbəblər sırasında Y xromosomu mikrodelesiyaları əhəmiyyətli yer tutsa da, onların da təsir payı bütün infertil kişilər arasında nisbətən məhduddur.
Bir çox hallarda obstruktiv azoospermiya (sperm istehsal olunur, lakin çıxışı bloklanıb), hipotalamo-hipofizar disfunksiya, infeksiyalar, varikosel, oksidativ stress, travmatik zədələr və ya ixtiyari dərman qəbulu kimi genetik olmayan faktorlar sonsuzluğun əsasını təşkil edir [15]. Bundan əlavə, idiopatik sonsuzluq hallarının (yəni etiologiyası bilinməyən) böyük hissəsində heç bir mikrodelesiya və ya genetik mutasiya olmaya bilər. Bu zaman epigenetik dəyişikliklər, qidalanma, piylənmə, hormonal disbalans, ətraf mühit toksinləri və psixososial stress kimi faktorların təsiri gündəmə gəlir [18].
Son tədqiqatlar göstərir ki, AZF mikrodelesiyalarının tezliyi və klinik təzahürü etnik və coğrafi fərqliliklərə görə əhəmiyyətli variasiya göstərir. Məsələn:
● Ərəb ölkələrində aparılmış geniş icmalda AZF mikrodelesiyalarının orta yayılma tezliyi 10.3% olaraq qeyd olunub, lakin bölgələr üzrə bu göstərici 1.6%–64% arasında dəyişir və AZFc alt bölgəsi ən çox təsadüf edilən formadır [8].
● Çində isə AZF delesiyalarının ümumi tezliyi təxminən 9%, bunların arasında AZFc 6%, AZFa 0.8% təşkil edir [33].
●Koreya populyasiyasında, non-obstruktiv azoospermiyalı və ağır oligozoospermiyalı pasiyentlərdə AZF mikrodelesiyalarının tezliyi 3%–15% arasında dəyişir [16].
Bundan əlavə, AZFc alt bölgəsindəki subtip delesiyalarının klinik təsiri də fərqlənir. Məsələn, gr/gr delesiyası olan pasiyentlərdə mikro‑TESE ilə sperm tapılma nisbəti 23.5% olduğu halda, b2/b3 və b2/b4 delesiyalarında bu göstəricilər müvafiq olaraq 54.5% və 64.5%-dir [14]. Bu, subtip səviyyəsində molekulyar differensiasiyanın reproduktiv proqnoza birbaşa təsir etdiyini sübut edir.
Mayalanmanın uğuru və embrionun keyfiyyəti də bu delesiyalardan təsirlənə bilir. Sperm sayı <1 mln/mL olan AZFc delesiyalı pasiyentlərdə embrionun euploidliyi və canlı doğum nisbəti aşağı olur, bu isə klinik idarəetmədə əlavə yanaşmalar tələb edir [34]. Lakin bəzi meta-analizlər, AZFc delesiyası olan kişilərdə ICSI nəticələrinin fərqli və dəyişkən olduğunu qeyd edir, bu da hər pasiyent üçün fərdiləşdirilmiş yanaşmanın vacibliyini göstərir [23]. Nəhayət, diagnostik metodlar da bu sahədə inkişaf etməkdədir. Yeni nəsil sekanslama (NGS) və qPCR arasında aparılan müqayisəli araşdırmalarda NGS-in b2/b3 kimi alt delesiyaları daha yüksək dəqiqliklə aşkarladığı, lakin qPCR metodunun bəzi spesifik bölgələrdə üstün olduğu bildirilmişdir [6].
YEKUN
Y xromosomunun AZF bölgəsində baş verən mikrodelesiyalar kişi sonsuzluğunun ən çox rast gəlinən genetik səbəblərindən biri kimi qəbul edilməkdədir. Ədəbiyyat məlumatları bu delesiyaların tezliyinin müxtəlif coğrafi regionlarda, populyasiyalarda və hətta etnik qruplar arasında ciddi dəyişkənlik göstərdiyini sübut edir. Bu dəyişkənlik, bir tərəfdən genetik fonun müxtəlifliyini, digər tərəfdən isə ətraf mühit faktorlarının və epigenetik mexanizmlərin təsirini əks etdirə bilər. Bununla belə, aparılan çoxsaylı klinik və molekulyar-genetik tədqiqatlar göstərir ki, hər bir delesiyanın reproduktiv nəticələri universal xarakter daşımır və sonsuzluqla əlaqəsi mütləq şəkildə qanunauyğun deyil.
Xüsusilə AZFc bölgəsində müşahidə olunan delesiyalar daha geniş spektrli klinik fenotiplərlə assosiasiya olunur. Bu hallarda spermatogenez prosesi tamamilə itirilməmiş, qismən qorunmuş ola bilər ki, bu da həmin xəstələrdə spermatozoidlərin mikro-TESE üsulu ilə əldə edilməsinə imkan yaradır. Digər tərəfdən, AZFa və AZFb bölgələrindəki mikrodelesiyalar daha ağır klinik nəticələrə gətirib çıxarır və çox vaxt tam azoospermiya ilə müşayiət olunur. Bu fərqlər mikrodelesiyaların klinik interpretasiyasının fərdi yanaşma tələb etdiyini bir daha təsdiqləyir.
Genetik testlərin tətbiqi burada həlledici əhəmiyyət kəsb edir. Onlar yalnız diaqnostik vasitə kimi deyil, həm də süni mayalanma prosedurlarının planlaşdırılmasında proqnostik marker rolunu oynayır. AZFc subtiplərinin dəqiq identifikasiyası ICSI uğur göstəricilərinin proqnozlaşdırılması baxımından klinik praktikada əhəmiyyətli nəticələr verir. Eyni zamanda genetik konsultasiya prosesi yalnız xəstənin mövcud fertil potensialının dəyərləndirilməsi ilə kifayətlənmir, həm də mümkün genetik risklərin və irsi ötürülmə ehtimallarının əvvəlcədən müəyyənləşdirilməsinə xidmət edir. Bu, cütlüklərin ailə planlaşdırmasında daha məlumatlı və rasional qərar verməsini təmin edən vacib klinik addımdır.
Nəticə etibarilə, Y xromosomunun AZF bölgəsində mikrodelesiyaların aşkarlanması və təhlili kişi sonsuzluğunun etiologiyasının öyrənilməsində mühüm rol oynayır. Bu yanaşma həm fərdi müalicə strategiyalarının hazırlanması, həm də reproduktiv seçimlərin düzgün istiqamətləndirilməsi baxımından aparıcı yer tutur. Gələcəkdə multiomik yanaşmaların (genomika, transkriptomika, epigenomika və proteomika) inteqrasiyası və yeni nəsil sekanslama texnologiyalarının daha geniş tətbiqi, sonsuzluğun molekulyar mexanizmlərinin daha dərindən başa düşülməsinə və yüksək dəqiqlikli, fərdiləşdirilmiş klinik qərarların formalaşdırılmasına şərait yaradacaqdır.
Şəkillər
Açar sözlər
İstinadlar
1.https://www.andrologyawareness.eu/
2.Agarwal, A., Mulgund, A., Hamada, A., & Chyatte, M. R. (2015). A unique view on male infertility around the globe. Reproductive biology and endocrinology, 13(1), 37.
3.Black, K., Ølgaard, S., Khoei, A. A., Glazer, C., Ohl, D. A., & Jensen, C. F. S. (2025). The Genetic Landscape of Male Factor Infertility and Implications for Men’s Health and Future Generations. Uro, 5(1), 2.
4.Chernykh, V. B., Bragina, E. E., Kurilo, L. F., Pankratenkova, M. A., Kashintsova, A. A., Gabliya, M. Y., ... & Kolomiets, O. L. (2025). Meiotic Arrest and Synaptonemal Complex failure in Infertile Men with Y Chromosome Microdeletions. Cytogenetic and Genome Research.
5.Colaco, S., & Modi, D. (2018). Genetics of the human Y chromosome and its association with male infertility. Reproductive biology and endocrinology, 16(1), 14.
6.Dai, B., Zhao, D., Sha, R. N., & Cang, M. (2025). The selection of Y chromosome microdeletion detection methods based on seminal analysis results: a comparison of high-throughput sequencing and fluorescence quantitative polymerase chain reaction (qPCR) applications. Translational Andrology and Urology, 14(3), 619.
7.Deng, C. Y., Zhang, Z., Tang, W. H., & Jiang, H. (2023). Microdeletions and vertical transmission of the Y-chromosome azoospermia factor region. Asian Journal of Andrology, 25(1), 5-12.
8.Ebrahim, F., & Al Manei, M. (2025). The frequency of Y-chromosome microdeletion among azoospermic males across Arab studies between 2014 and 2024: scoping review. Middle East Fertility Society Journal, 30(1), 8.
9.Esteves, S. C., Miyaoka, R., & Agarwal, A. (2011). An update on the clinical assessment of the infertile male. Clinics, 66(4), 691-700.
10.Flannigan, R., & Schlegel, P. N. (2017). Genetic diagnostics of male infertility in clinical practice. Best Practice & Research Clinical Obstetrics & Gynaecology, 44, 26-37.
11.Foresta, C., Moro, E., & Ferlin, A. (2001). Y chromosome microdeletions and alterations of spermatogenesis. Endocrine reviews, 22(2), 226-239.
12.Hopps, C. V., Mielnik, A., Goldstein, M., Palermo, G. D., Rosenwaks, Z., & Schlegel, P. N. (2003). Detection of sperm in men with Y chromosome microdeletions of the AZFa, AZFb and AZFc regions. Human reproduction, 18(8), 1660-1665.
13.Hotaling, J. M. (2014). Genetics of male infertility. Urologic Clinics, 41(1), 1-17.
14.Xia, Y., Feng, K., Qu, X., Wan, F., Zhang, C., & Guo, H. (2025). Impact of AZFc deletion subtypes on sperm retrieval rates via micro-TESE and ICSI outcomes in non-obstructive azoospermia patients. Scientific Reports, 15(1), 22148.
15.Jungwirth, A., Giwercman, A., Tournaye, H., Diemer, T., Kopa, Z., Dohle, G., ... & EAU Working Group on Male Infertility. (2012). European Association of Urology guidelines on Male Infertility: the 2012 update. European urology, 62(2), 324-332.
16.Kim, M. J., Choi, H. W., Park, S. Y., Song, I. O., Seo, J. T., & Lee, H. S. (2012). Molecular and cytogenetic studies of 101 infertile men with microdeletions of Y chromosome in 1,306 infertile Korean men. Journal of assisted reproduction and genetics, 29(6), 539-546.
17.Komori, S., Kato, H., Kobayashi, S. I., Koyama, K., & Isojima, S. (2002). Transmission of Y chromosomal microdeletions from father to son through intracytoplasmic sperm injection. Journal of human genetics, 47(9), 465-468.
18.Krausz, C., Escamilla, A. R., & Chianese, C. (2015). Genetics of male infertility: from research to clinic. Reproduction, 150(5), R159-R174.
19.Krausz, C., & Casamonti, E. (2017). Spermatogenic failure and the Y chromosome. Human genetics, 136(5), 637-655.
20.Yamaguchi, K., Ishikawa, T., Mizuta, S., Doi, K., Takaya, Y., Suzuki, Y., ... & Matsubayashi, H. (2024). O-263 The risk of hypogonadism after microdissection testicular sperm extraction (micro TESE) in non-obstructive azoospermia (NOA) patients with various etiologies. Human Reproduction, 39(Supplement_1), deae108-310.
21.Pazoki, N., Salehi, M., Angaji, S. A., & Abdollahpour‐Alitappeh, M. (2024). Association of Y chromosome AZF region microdeletions with recurrent miscarriage in Iranian couples: a case–control study. Molecular Genetics & Genomic Medicine, 12(2), e2392.
22.Rao, M. V., ShAh, N. P., Raval, R. J., SOlANki, P. P., Shah, S. C., & ShAh, S. C. (2021). Current status of y chromosome microdeletions: prevalence, distribution, implication and association with Male infertility in Indian men-a review. J Clin Diagn Res, 15(3).
23.Rizal, D. M., Setyawati, I., Adiningrat, A., Widiyatmoko, A., & Septiyorini, N. (2024). Molecular Study on Y Chromosome Microdeletion in Male Infertility: A Cross-Sectional Design in Indonesian Men. OBM Genetics, 8(1), 1-12.
24.Sethi, S., & Singh, R. (2024). Y-Chromosome Deletion Testing in Infertility. In Genetic Testing in Reproductive Medicine (pp. 17-29). Singapore: Springer Nature Singapore.
25.Sharma, R., Biedenharn, K. R., Fedor, J. M., & Agarwal, A. (2013). Lifestyle factors and reproductive health: taking control of your fertility. Reproductive biology and endocrinology, 11(1), 66.
26.Şen, E., Kızılkan, Y., Duran, M. B., Turunç, T., Şahin, F. İ., & Özkardeş, H. (2023). Evaluation of the genetic analysis results in infertile patients with non-obstructive azoospermia. Journal of Urological Surgery.
Tiepolo, L., & Zuffardi, O. (1976). Localization of factors controlling spermatogenesis in the nonfluorescent portion of the human Y chromosome long arm. Human genetics, 34(2), 119-124.
27.Tüttelmann, F., & Röpke, A. (2017). Genetics of male infertility. In Endocrinology of the testis and male reproduction (pp. 1029-1049). Springer, Cham.
28.Vog, P. H., Edelmann, A., Kirsch, S., Henegariu, O., Hirschmann, P., Kiesewetter, F., ... & Haidl, G. (1996). Human Y chromosome azoospermia factors (AZF) mapped to different subregions in Yq11. Human molecular genetics, 5(7), 933-943.
29.Vogt, P. H. (1998). Human chromosome deletions in Yq11, AZF candidate genes and male infertility: history and update. Molecular human reproduction, 4(8).
30.Vogt, P. H. (2004). Genomic heterogeneity and instability of the AZF locus on the human Y chromosome. Molecular and Cellular Endocrinology, 224(1-2), 1-9.
31.Vogt, P. H., Bender, U., Deibel, B., Kiesewetter, F., Zimmer, J., & Strowitzki, T. (2021). Human AZFb deletions cause distinct testicular pathologies depending on their extensions in Yq11 and the Y haplogroup: new cases and review of literature. Cell & Bioscience, 11(1), 60.
32.Zhao, Y., Zhi, W., Xiong, D., Li, N., Du, X., Zeng, J., ... & Liu, W. (2025). A family with normal sperm motility carrying a sY86 deletion in AZFa region and partial deletion in AZFc region. Frontiers in Genetics, 15, 1519774.
33.Zhou, Y., Deng, C. C., Liu, W. J., Liu, H., Zheng, H. B., Tang, Y. G., ... & Deng, J. H. (2021). Reproductive outcomes of intracytoplasmic sperm injection using testicular sperm and ejaculated sperm in patients with AZFc microdeletions: a systematic review and meta-analysis. Asian Journal of Andrology, 23(5), 495-500.
Məqalə barədə təfərrüatlar:
Nəşr tarixçəsi
Dərc edilib: 26.Nov.2025
Müəllif hüququ
© 2022-2025. Azərbaycan Tibb Universitetinin nəşri. Jurnalın elektron versiyası "Uptodate in Medicine" tibb nəşriyyatı tərəfindən dərc olunur. Bütün hüquqlar qorunur.Əlaqəli məqalələr
Baxılıb: 786



