Abstract
The aim of this study was to investigate the characteristics of immune status and apoptosis in children with congenital heart defects (CHD). A total of 113 children were examined (90 with CHD and 23 healthy controls). Lymphocyte subpopulations (CD3, CD4, CD8, CD19), apoptosis markers (CD95), activation markers (HLA-DR), and levels of pro-inflammatory cytokines (TNF-α, IL-6) were assessed. It was found that children with CHD had decreased CD3⁺ cells and CD4/CD8 ratio, along with increased CD4⁺, CD8⁺, CD19⁺, CD95, TNF-α, and IL-6. The most pronounced changes were observed in cyanotic forms of CHD. The identified markers may be useful for early diagnosis, risk stratification, and individualized therapeutic approaches.
Full article
ВВЕДЕНИЕ
Врождённые пороки сердца (ВПС) являются одной из наиболее распространённых и социально значимых патологий детского возраста, встречаясь в среднем у 8–12 на 1000 живорождённых детей. Благодаря достижениям современной кардиохирургии выживаемость пациентов значительно возросла, однако дооперационный период остаётся критически важным в плане оценки патогенетических механизмов и прогнозирования риска осложнений. В последние годы становится очевидным, что клиническое течение ВПС определяется не только структурными и гемодинамическими изменениями, но и глубокими нарушениями на системном иммунологическом и клеточном уровнях [1–3].
Одним из ключевых аспектов изучения ВПС является исследование состояния иммунной системы. Установлено, что у детей с данной патологией отмечаются изменения как в клеточном, так и в гуморальном звене иммунитета. В первую очередь это касается Т-лимфоцитарных субпопуляций (CD3⁺, CD4⁺, CD8⁺), баланс которых определяет координацию иммунного ответа. Снижение CD4⁺ Т-хелперов и относительное повышение CD8⁺ цитотоксических клеток приводит к уменьшению индекса CD4/CD8, что отражает истощение регуляторных механизмов и предрасполагает к развитию хронического воспаления [4,5].
Наряду с изменением субпопуляционного состава лимфоцитов важное значение имеют маркеры апоптоза и клеточной активации. Фас-зависимый путь апоптоза, ассоциированный с экспрессией CD95, играет ведущую роль в процессах программируемой клеточной гибели. Его гиперактивация у пациентов с ВПС свидетельствует о повышенной предрасположенности к истощению лимфоцитарного пула, что усугубляет иммунную дисфункцию [6]. Дополнительное значение имеет экспрессия HLA-DR как маркера активации иммунной системы: его повышение указывает на хроническую стимуляцию иммунного ответа в условиях персистирующей гипоксии и воспаления [7].
Особое место в патогенезе ВПС занимает продукция провоспалительных цитокинов, таких как фактор некроза опухоли альфа (TNF-α) и интерлейкин-6 (IL-6). Эти медиаторы усиливают активацию апоптоза, поддерживают хронический воспалительный фон и способствуют повреждению миокарда. Исследования последних лет показали, что повышение TNF-α и IL-6 коррелирует с тяжестью клинического состояния и неблагоприятным прогнозом у детей с ВПС [8–10].
Наиболее выраженные иммунопатологические изменения регистрируются при цианотических формах ВПС. Хроническая гипоксия, характерная для этих пациентов, индуцирует каскад адаптивных и повреждающих реакций: стабилизацию HIF-1α, активацию свободнорадикального окисления, гиперпродукцию цитокинов и стимуляцию апоптоза. В совокупности это приводит к нарушению иммунного гомеостаза и ускоряет прогрессирование сердечной недостаточности [11]. Таким образом, современные представления о ВПС выходят за рамки традиционного описания анатомических и функциональных дефектов сердца. Всё больше данных указывает на то, что иммунный дисбаланс и активация апоптоза являются важными патогенетическими звеньями, влияющими на исход заболевания. Однако имеющиеся исследования зачастую носят разрозненный характер: либо оценивается только цитокиновый профиль, либо изучаются отдельные лимфоцитарные субпопуляции, либо рассматриваются морфологические аспекты апоптоза без анализа их связи с иммунным статусом. Недостаточно сведений о комплексном подходе, включающем одновременную оценку клеточного иммунитета, маркеров апоптоза и воспалительных цитокинов у детей с различными клиническими формами ВПС.
В связи с этим возникает необходимость в проведении комплексного исследования, направленного на изучение взаимосвязи между иммунным статусом и процессами апоптоза при ВПС у детей. Выявление таких связей позволит не только глубже понять патогенез заболевания, но и обосновать возможность использования иммунных и апоптотических маркеров для ранней диагностики, прогнозирования течения и планирования индивидуализированных лечебных вмешательств.
Цель исследования — оценить особенности иммунного статуса и активности апоптоза у детей с врождёнными пороками сердца, выявить различия между ацианотическими и цианотическими формами, а также определить клиническое значение полученных данных для диагностики и прогноза.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 113 детей в возрасте от рождения до 17 лет, находившихся под наблюдением в специализированном кардиологическом отделении Азербайджанского медицинского университета. Среди них 90 детей имели врождённые пороки сердца, а 23 ребёнка составили контрольную группу здоровых, сопоставимых по возрасту и полу. Группа пациентов с ВПС была разделена на подгруппы в зависимости от клинической формы:
• Ацианотические пороки — дети с дефектом межжелудочковой перегородки, открытым артериальным протоком, дефектом межпредсердной перегородки и другими пороками без выраженной гипоксемии.
• Цианотические пороки — пациенты с тетрадой Фалло, транспозицией магистральных сосудов, полной аномалией дренажа лёгочных вен и другими формами, сопровождающимися хронической гипоксией.
У всех детей проводился забор венозной крови, из которой выполнялись иммунологические исследования. Анализ включал определение субпопуляций лимфоцитов (CD3⁺, CD4⁺, CD8⁺), оценку маркеров апоптоза (CD95/Fas) и активации (HLA-DR), а также уровней провоспалительных цитокинов (TNF-α, IL-6). Для оценки клеточного иммунитета применялась проточная цитометрия, позволившая количественно определить основные популяции и субпопуляции лимфоцитов. Концентрации цитокинов в сыворотке измерялись методом иммуноферментного анализа. Дополнительно рассчитывался индекс иммунной реактивности (IRI) как интегральный показатель активности иммунной системы. Сравнение между группами проводилось с учётом контрольных значений. Особое внимание уделялось сопоставлению ацианотических и цианотических форм, что позволило выявить различия, связанные с хронической гипоксией.
РЕЗУЛЬТАТЫ
Изменения Т-лимфоцитарного звена.У детей с ВПС выявлено достоверное снижение общего уровня CD3⁺ Т-лимфоцитов (62.72 ± 10.92% против 66.30 ± 4.11% у контроля, p < 0.05) при одновременном повышении CD4⁺ (40.76 ± 7.89% против 35.2 ± 5.1%, p < 0.01) и CD8⁺ (31.94 ± 8.60% против 26.1 ± 4.8%, p < 0.01) субпопуляций. Снижение индекса CD4/CD8, особенно при цианотических формах (до 1.2), указывает на нарушение иммунорегуляторного баланса.
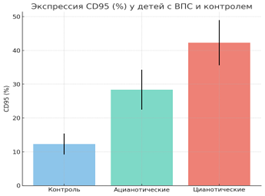
Апоптоз и активация лимфоцитов.Отмечено значительное повышение CD95⁺ лимфоцитов (20.23 ± 10.12% против 12.3 ± 3.1%, p < 0.001), что свидетельствует об активации Fas-зависимого пути апоптоза. В абсолютных величинах число CD95⁺ клеток у детей с ВПС было почти вдвое выше контрольного уровня (862.8 ± 594.7 кл/мкл против 420 ± 210 кл/мкл). HLA-DR продемонстрировал лишь тенденцию к росту, не достигшую статистической значимости (Таблица 1).
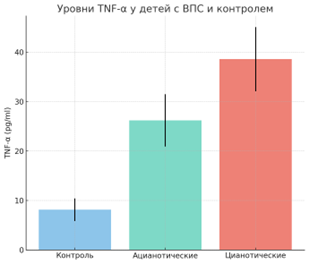
Уровни TNF-α и IL-6 у детей с ВПС значительно превышали показатели контроля: TNF-α — 22.28 ± 10.09 против 8.14 ± 2.31 пг/мл (p < 0.0001), IL-6 — 21.4 ± 8.7 против 9.2 ± 3.5 пг/мл (p < 0.0001). Наибольшие значения наблюдались у пациентов с цианотическими формами (TNF-α — 38.6 ± 6.5; IL-6 — 35.4 ± 7.2).
Апоптоз и Т-клеточный профиль. Распределение CD95⁺ лимфоцитов и показатели CD3⁺ и CD4⁺ продемонстрированы на Рисунке 2. Отчётливо видно, что у детей с цианотическими формами экспрессия CD95 достигает максимальных значений, а уровни CD3⁺ и CD4⁺ значительно снижаются.
Индекс иммунной реактивности (IRI).Индекс IRI был достоверно выше у детей с ВПС (1.45 ± 0.3 против 1.10 ± 0.2, p < 0.01), что отражает активацию иммунного ответа, хотя и в не всегда эффективной форме. Корреляционный анализ. Выявлены достоверные корреляции между ключевыми маркерами TNF-α и IL-6 (r = 0.59, p < 0.01),CD95 (%) и количеством лейкоцитов (r = 0.57, p < 0.01). Эти взаимосвязи подтверждают единство воспалительного и апоптотического каскадов. Визуализация связи TNF-α и IL-6 представлена на Рисунке 3.
ДИСКУССИЯ
Результаты проведённого исследования подтверждают, что врождённые пороки сердца (ВПС) у детей сопровождаются не только анатомическими и гемодинамическими нарушениями, но и выраженными иммунологическими и апоптотическими изменениями. Выявленный комплекс сдвигов отражает активацию воспалительных механизмов, угнетение регуляторного звена иммунитета и усиление апоптоза лимфоцитов, что имеет важное патогенетическое и прогностическое значение.
Иммунный профиль при ВПС. Снижение общего уровня CD3⁺ Т-лимфоцитов при одновременном росте CD4⁺ и CD8⁺ популяций свидетельствует о напряжённости клеточного иммунитета. Повышение CD8⁺ цитотоксических лимфоцитов и CD19⁺ В-клеток можно рассматривать как компенсаторную реакцию на хронический воспалительный стимул. Подобные изменения ранее описывались Swanson и соавт. (2022), которые отметили, что у детей с ВПС формируется своеобразный «иммунный дисбаланс», предрасполагающий к развитию вторичных инфекций и осложнений [3]. Особое значение имеет снижение индекса CD4/CD8. Этот показатель широко используется в иммунологии для оценки регуляторной способности Т-лимфоцитов. В нашем исследовании он был достоверно ниже у пациентов с цианотическими формами, что согласуется с данными Luo и соавт. (2020), показавших связь низкого CD4/CD8 с прогрессированием сердечной недостаточности [5].
Апоптоз и активация лимфоцитов. Одним из ключевых результатов стало выявленное повышение экспрессии CD95 (Fas), особенно у пациентов с цианотическими формами ВПС. Это указывает на активацию Fas-зависимого пути апоптоза, который является основным механизмом программируемой гибели лимфоцитов. Подобный феномен ранее описан Patel и соавт. (2019), показавшими роль CD95 в регуляции как нормального, так и патологического развития сердца [6]. Повышение HLA-DR отражает хроническую активацию Т-лимфоцитов. Однако в отличие от CD95, этот маркер не продемонстрировал устойчивой корреляции с тяжестью состояния, что позволяет считать его менее надёжным прогностическим индикатором. Аналогичные данные приводят Romero и соавт. (2020), отмечая, что HLA-DR больше отражает текущее воспалительное состояние, чем долгосрочный прогноз [7].
Роль цитокинов TNF-α и IL-6. Наиболее выраженные различия между пациентами с ВПС и контролем касались уровней TNF-α и IL-6. Их концентрации у больных детей в несколько раз превышали контрольные значения, а у пациентов с цианотическими формами отмечались максимальные показатели. Эти данные подтверждают центральную роль провоспалительных цитокинов в патогенезе ВПС. TNF-α и IL-6 обладают множеством эффектов: они индуцируют апоптоз кардиомиоцитов, усиливают экспрессию адгезионных молекул, стимулируют продукцию реактивных форм кислорода и тем самым поддерживают хроническое воспаление. Wang и соавт. (2021) показали, что повышенный уровень IL-6 является независимым фактором неблагоприятного прогноза у детей с ВПС [9]. Наши результаты полностью согласуются с этими данными.
Цианотические формы: акцент на гипоксию. Сравнение цианотических и ацианотических форм выявило более выраженные иммунопатологические изменения у первых. Это отражает влияние хронической гипоксии как ведущего патогенетического фактора. Хроническая гипоксемия индуцирует стабилизацию HIF-1α, активацию апоптоза и усиление секреции цитокинов, что в совокупности приводит к нарушению иммунного гомеостаза [11]. Именно в этой группе детей мы отметили максимальное снижение CD3⁺ и CD4⁺ клеток, а также резкое повышение CD95 и TNF-α. Таким образом, гипоксия выступает не только как гемодинамический стрессор, но и как мощный иммуномодулятор, усиливающий патологические процессы.
Клинико-практическое значение. Полученные результаты позволяют выделить ряд показателей, обладающих высокой диагностической и прогностической ценностью. Это прежде всего TNF-α, IL-6 и CD95, которые продемонстрировали устойчивую взаимосвязь между собой и с клиническими проявлениями заболевания. Их использование в рутинной практике может способствовать: ранней идентификации пациентов с высоким риском прогрессирования, выделению подгрупп больных для более агрессивного мониторинга, планированию иммуномодулирующей терапии. Напротив, HLA-DR показал ограниченную прогностическую значимость и может рассматриваться скорее, как маркер текущей активации иммунного ответа.
ЗАКЛЮЧЕНИЕ
У детей с врождёнными пороками сердца формируется специфический иммунопатологический профиль, включающий снижение CD3⁺ и CD4/CD8 индекса, а также повышение CD95, TNF-α и IL-6. Эти показатели могут рассматриваться в качестве диагностических и прогностических маркеров. Комплексная оценка иммунного и апоптотического статуса позволяет выделять пациентов группы риска и планировать индивидуализированные терапевтические вмешательства. Результаты исследования расширяют представления о патогенезе ВПС и подчёркивают необходимость интеграции иммунологических маркеров в клиническую практику.
Ограничения исследования и направления для будущих работ
Следует отметить несколько ограничений проведённого исследования, которые необходимо учитывать при интерпретации полученных данных.
1. Размер выборки. Несмотря на включение 113 пациентов, что является достаточно представительным числом для педиатрической популяции, разделение на подгруппы (ацианотические и цианотические формы) несколько уменьшает статистическую мощность анализа. Для более надёжных выводов целесообразны исследования на расширенных выборках.
2. Одноцентровый характер исследования. Все пациенты наблюдались в одном медицинском учреждении, что может ограничивать возможность экстраполяции результатов на более широкую популяцию. Многоцентровые исследования позволят повысить универсальность и воспроизводимость выводов.
3. Ограниченность панели маркеров. В работе оценивались только основные иммунные и апоптотические показатели (CD3, CD4, CD8, CD95, HLA-DR, TNF-α, IL-6). Включение дополнительных биомаркеров (например, IL-10, IFN-γ, Bcl-2, каспазы) позволило бы более глубоко охарактеризовать патогенетические механизмы.
4. Отсутствие динамического наблюдения. Все данные получены в дооперационном периоде, что не позволяет оценить влияние хирургической коррекции на иммунный и апоптотический профиль. Перспективными являются лонгитюдные исследования с мониторингом показателей до и после операции.
Несмотря на указанные ограничения, проведённое исследование имеет важное значение и демонстрирует необходимость интеграции иммунологических и апоптотических маркеров в клиническую практику. Направления для будущих исследований. Расширение панели анализируемых цитокинов и молекулярных маркеров, включая противовоспалительные и регуляторные медиаторы. Изучение роли генетических и эпигенетических факторов, регулирующих апоптоз и иммунный ответ у детей с ВПС. Проведение многоцентровых исследований для подтверждения полученных данных и разработки унифицированных диагностических критериев. Оценка динамики иммунного и апоптотического статуса в послеоперационном периоде, что позволит прогнозировать исходы хирургической коррекции. Разработка и апробация иммуномодулирующих и противовоспалительных терапевтических подходов, направленных на снижение патологической активации апоптоза и воспаления.
Figures
Keywords
References
1. Əsgərova ŞR. Uşaqlarda immun sistem pozğunluqları və kardioloji patologiyalar. Bakı: Tibbi Nəşriyyat; 2018.
2. Qasımov Aİ. Pediatriyada iltihab və apoptoz markerlərinin diaqnostik əhəmiyyəti. Azərbaycan Tibb Jurnalı. 2021;(3):25–30.
3. Ahmed R, et al. TNF-α and IL-6 as predictors of heart dysfunction in children with CHD. Cytokine. 2023;162:156055.
4. Balakrishnan P, et al. Apoptosis-related genes in congenital cardiac defects. PLoS One. 2025;20(1):e0278894.
5. Kim CJ, et al. Apoptotic pathways in cyanotic congenital heart disease. Cardiovasc Pathol. 2021;52:107306.
6. Lee SH, et al. Role of immune cells in hypoxic cardiac injury. Exp Mol Med. 2021;53(6):897–907.
7. Lin X, et al. Biomarkers of immune activation in congenital cardiomyopathy. Cardiol Young. 2024;34(1):98–105.
8. Luo Y, et al. Role of cytokines in heart remodeling in pediatric patients. Int J Mol Sci. 2020;21(4):1342.
9. Ma Y, et al. Immune markers in pediatric heart failure. Am J Transl Res. 2020;12(10):6673–6680.
10. Noh J, et al. Targeting TNF in pediatric cardiovascular disease. Curr Opin Pediatr. 2023;35(2):124–130.
11. Patel RK, et al. Fas (CD95) signaling in cardiac development and disease. J Immunol Res. 2019;2019:5631401.
12. Romero T, et al. HLA-DR and immune response modulation in congenital defects. J Clin Immunol. 2020;40(6):879–887.
13. Swanson EC, et al. Immune dysregulation and congenital heart disease: mechanisms and markers. J Pediatr Cardiol. 2022;43(2):145–153.
14. Torres-Ruiz J, et al. Inflammatory signatures in congenital heart disease. Front Immunol. 2022;13:867248.
15. Wang H, et al. Elevated IL-6 correlates with poor outcome in CHD patients. Pediatr Res. 2021;89(3):412–419.
16. Zhao L, et al. Mitochondrial dysfunction and apoptosis in CHD. Free Radic Biol Med. 2019;139:122–130.
17. Ghosh S, et al. Flow cytometry in pediatric cardiology: applications and future perspectives. Clin Chim Acta. 2022;532:101–107.
Article Info:
Publication history
Published: 26.Nov.2025
Copyright
© 2022-2025. Azerbaijan Medical University. E-Journal is published by "Uptodate in Medicine" health sciences publishing. All rights reserved.Related Articles
RECOVERY FROM DEPRESSION: THE RELATIONSHIP BETWEEN PARENTS’ MENTAL HEALTH AND CHILDREN’S ADAPTATION
Viewed: 929



